当前位置:沧州泰鼎恒业试验仪器有限公司 > 新闻资讯 > 技术文章 > 技术文章
水泥化学分析方法—试剂和材料
时间:2020-03-18来源:泰鼎恒业浏览次数:
6 化学分析方法
6.1 试剂和材料
6.1.1 盐酸(HCl) 6.1 试剂和材料
1.18gcm3~1.19g/cm3,质量分数36%~38%
6.1.2 氢氟酸(HF)
1.15g/cm3~1.18 g/cm3,质量分数40%。
6.1.3 硝酸(HNO3)
1.39g/cm3~1.41g/cm3,质量分数65%~68%。
6.1.4 硫酸(H2SO4)
1.84 g/cm3,质量分数95%~98%。
6.1.5 高氯酸(HClO4)
1.60 g/cm3,质量分数70%~72%。
6.1.6 冰乙酸(CH3COOH)
1.05g/cm3质量分数99.8%.
6.1.7 磷酸(H3PO4)
1.68 g/cm3,质量分数85%.
6.1.8 甲酸(HCOOH)
1.22g/cm3,质量分数88%.
6.1.9 过氧化氢(H2O2)
1.11 g/cm3,质量分数30% .
6.1.10 氨水(NH3·H2O)
0.90g/cm3~0.91g/cm3,质量分数25%~28%
6.1.11 三乙醇胺[N(CH2CH2OH)3]
1.12g/cm3,质量分数99%
6.1.12 乙醇
乙醇的体积分数95%
6.1.13 无水乙醇(C2H5OH)
无水乙醇的体积分数不低于99.5%。
6.1.14 丙三醇[C3H5(OH)3]
体积分数不低于99% 。
6.1.15 乙二醇(HOCH2CH2OH)
体积分数99%
6.1.16 溴水(Br2)
质量分数≥3%。
6.1.17 盐酸(1+1);(1+2);(1+3);(1+5);(1+9);(1+10);(3+97)
6.1.18 硝酸(1+1);(1+2);(1+9);(1+100)
6.1.19 硫酸(1+1);(1+4);(1+9);(5+95)
6.1.20 磷酸(1+1)
6.1.21 乙酸(1+1)
6.1.22 甲酸(1+1)
6.1.23 氨水(1+1)
6.1.24 乙醇(1+4)
6.1.25 三乙醇胺(1+2)
6.1.26 氢氧化钠(NaOH)
6.1.27 无水碳酸钠(Na2CO3)
将无水碳酸钠用玛瑙研钵研细至粉末状,贮存于密封瓶中。
6.1.28 氯化铵(NH4Cl).
6.1.29 焦硫酸钾(K2S2O7) .
将市售的焦硫酸钾在蒸发皿中加热熔化,加热至无气泡产生,冷却并压碎熔融物,贮存于密封瓶中。
6.1.30 氯化钡溶液(100g/L)
将100g氯化钡(BaCl2·2H2O)溶于水中,加水稀释至1L,必要时过滤后使用。
6.1.31 硝酸银溶液(5g/L)
将0.5g 硝酸银(AgNO3)溶于水中加入1mL硝酸,加水稀释至100mL,贮存于棕色瓶中。
6.1.32 氢氧化钠溶液(10 g/L)
将10 g氢氧化钠(NaOH)溶于水中,加水稀释至1L,贮存于塑料瓶中。
6.1.33 硝酸铵溶液(20g/L)
将2g硝酸铵(NH4NO3)溶于水中,加水稀释至100mL。
6.1.34 钼酸铵溶液(50g/L)
将5g钼酸铵[(NH4)6Mo7O24·4H2O]溶于热水中,冷却后加水稀释至100mL,贮存于塑料瓶中,必要时过滤后使用。此溶液在一周内使用。
6.1.35 抗坏血酸溶液(5g/L)
将 0.5 g抗坏血酸(V.C)溶于100mL水中,必要时过滤后使用。用时现配。
6.1.36 邻菲罗啉溶液(10 g/L乙酸溶液)
将1g邻菲罗啉(C12H8N2·2H2O)溶于100mL乙酸(1+1)中,用时现配。
6.1.37 乙酸铵溶液(100g/L)
将10g 乙酸铵(CH3COONH4)溶于100mL水中。
6.1.38 pH3.0的缓冲溶液
将3.2g无水乙酸钠(CH3COONa)溶于水中,加入120mL冰乙酸,加水稀释至1L。配制后用精密pH试纸检验。
6.1.39 氢氧化钾溶液(200 g/L)
将200g氢氧化钾(KOH)溶于水中,加水稀释至1L,贮存于塑料瓶中。
6.1.40 氯化银溶液(银50g/L
将152g氯化镖(SrCl2·6H2O)溶解于水中,加水稀释至1L,必要时过滤后使用。
6.1.41 二安替比林甲烷溶液(30g/L盐酸溶液)
将3g二安替比林甲烷(C23H24N4O2)溶于100mL热的盐酸(1+10)中,必要时过滤后使用。
6.1.42 碳酸铵溶液(100g/L)
将10g碳酸铵[(NH4)2CO3]溶解于100mL水中。用时现配。
6.1.43 氯化亚锡(SnCl2·2H2O)
6.1.44 氨性硫酸锌溶液(100g/L)
将50 g硫酸锌(ZnSO4·7H2O)溶于150mL水和350mL氨水中。静置至少24h后使用,必要时过滤后使用。
6.1.45 明胶溶液(5 g/L)
将 0.5g明胶(动物胶)溶于100mL70℃~80℃的水中。用时现配。
6.1.46 碳酸钠-硼砂混合熔剂(2+1)
将2份质量的无水碳酸钠(Na2CO3)与1份质量的无水硼砂(Na2B4O7)混匀研细,贮存于密封瓶中。
6.1.47 高碘酸钾(KIO4)
6.1.48 氢氧化钠溶液(200g/L)
将20g氢氧化钠(NaOH)溶于水中,加水稀释至100mL,贮存于塑料瓶中。
6.1.49 钼酸铵溶液(15g/L)
将3g钼酸铵[(NH4)6Mo7O24·4H2O]溶于100mL.热水中,加入60mL硫酸(1+1),混匀。冷却后加水稀释至200mL.贮存于塑料瓶中,必要时过滤后使用。此溶液在一周内使用。
6.1.50 抗坏血酸溶液(50 g/L)
将5g抗坏血酸(V.C)溶于100mL水中,必要时过滤后使用。用时现配。
6.1.51 氯化钾(KCl)
颗粒粗大时,研细后使用。
6.1.52 氟化钾溶液(150 g/L)
将150g氟化钾(KF·2H2O)置于塑料杯中,加水溶解后,加水稀释至1L,贮存于塑料瓶中。
6.1.53 氯化钾溶液(50 g/L)
将50 g氯化钾(KCl)溶于水中加水稀释至1L.
6.1.54 氯化钾乙醇溶液(50 g/L)
将5g氯化钾(KCl)溶于50 mL水后,加入50 mL乙醇(6.1.12),混匀。
6.1.55 pH4.3的缓冲溶液
将42.3 g无水乙酸钠(CH3COONa)溶于水中,加入80mL冰乙酸,加水稀释至1L。配制后用精密pH 试纸检验。
6.1.56 氟化钾溶液(20g/L)
将20g氟化钾(KF·2H2O)置于塑料杯中,加水溶解后,加水稀释至1L,贮存于塑料瓶中。
6.1.57 草酸铵溶液(50 g/L)
将50 g草酸铵[(NH4)2C2O4 ·H2O)]溶于水中,加水稀释至1L,必要时过滤后使用。
6.1.58 酒石酸钾钠溶液(100 g/L)
将10g酒石酸钾钠(C4H4KNaO6·4H2O)溶于水中,加水稀释至100mL。
6.1.59 pH10的缓冲溶液
将 67.5 g氯化铵(NH4Cl)溶于水中,加入 570 mL氨水,加水稀释至1L。配制后用精密pH试纸检验。
6.1.60 盐酸羟胺(NH2OH·HCl)
6.1.61 氯化亚锡磷酸溶液
将1000mL 磷酸放在烧杯中,在通风橱中于电炉上加热脱水,至溶液体积缩减至 850mL~950mL时,停止加热。待溶液温度降至100℃以下时,加入100g氯化亚锡(6.1.43),继续加热至溶液透明,且无大气泡冒出时为止(此溶液的使用期一般不超过两周)。
6.1.62 H型732苯乙烯强酸性阳离子交换树脂(1×12)
将250g钠型732苯乙烯强酸性阳离子交换树脂(1×12)用250mL乙醇(6.1.12)浸泡12h以上,然后倾出乙醇,再用水浸泡 6h~8h。将树脂装入离子交换柱中,用1500mL盐酸(1+3)以5mL/min的流速淋洗。然后再用蒸馏水逆洗交换柱中的树脂,直至流出液中无氯离子为止(4.7)。将树脂倒出,用布氏漏斗抽气抽滤,然后贮存于广口瓶中备用(树脂久放后,使用时应用水倾洗数次)。
用过的树脂浸泡在稀盐酸中,当积至一定数量后,除去其中夹带的不溶残渣,然后再用上述方法进行再生.
6.1.63 五氧化二钒(V2O5)
6.1.64 电解液
将6g碘化钾(KI)和6g溴化钾(KBr)溶于300 mL水中,加入10 mL冰乙酸。
6.1.65 pH 6.0的总离子强度配位缓冲溶液
将294.1g 柠檬酸钠(C6H5Na3O7·2H2O)溶于水中,用盐酸(1+1)和氢氧化钠溶液(6.1.48)调整溶液的pH至6.0,用精密pH试纸检验,加水稀释至1L。
6.1.66 氢氧化钠-无水乙醇溶液(0.1mol/L)
将0.4g氢氧化钠(NaOH)溶于100mL无水乙醇(6.1.13)中,防止吸潮。
6.1.67 甘油-无水乙醇溶液(1+2)
将500mL丙三醇(6.1.14)与1000mL无水乙醇(6.1.13)混合,加入 0.1g酚酞,混匀。用氢氧化钠-无水乙醇溶液(6.1.66)中和至微红色。贮存于干燥密封的瓶中,防止吸潮。
6.1.68 硝酸银[Sr(NO3)2]
6.1.69 乙二醇-无水乙醇溶液(2+1)
将1000mL乙二醇(6.1.15)与500mL无水乙醇(6.1.13)混合,加入0.2g酚酞,混匀。用氢氧化钠-无水乙醇溶液(6.1.66)中和至微红色。贮存于干燥密封的瓶中,防止吸潮。
6.1.70 硝酸银标准溶液[c(AgNO3))=0.05 mol/L]
称取2.1235g已于(150±5)℃烘过2h的硝酸银(AgNO3),精确至0.0001g,置于烧杯中,加水溶解后,移入250mL容量瓶中,加水稀释至刻度,摇匀。贮存于棕色瓶中,避光保存。
6.1.71 硫氰酸铵标准滴定溶液[c(NH4SCN)=0.05mol/L]
称取(3.8±0.1)g硫氰酸铵(NH4SCN)溶于水,稀释至1L。
6.1.72 二氧化硅(SiO2))标准溶液
6.1.72.1 二氧化硅标准溶液的配制
称取0.200 g已于1000℃~1100℃灼烧过1h的二氧化硅(SiO2,光谱纯),精确至0.0001g,置于铂坩埚中,加入2g无水碳酸钠(6.1.27),搅拌均匀,在950℃~1000℃高温下熔融15min。冷却后,将熔融物浸出于盛有约100mL沸水的塑料烧杯中,待全部溶解,冷却至室温后,移入1000mL容量瓶中。用水稀释至刻度,摇匀,贮存于塑料瓶中。此标准溶液每毫升含0.2mg二氧化硅。
吸取50.00mL上述标准溶液放入500mL容量瓶中,用水稀释至刻度,摇匀,贮存于塑料瓶中。此标准溶液每毫升含0.02mg二氧化硅。
6.1.72.2 工作曲线的绘制
吸取每毫升含0.02mg二氧化硅的标准溶液0mL、2.00mL、4.00mL、5.00mL、6.00mL、8.00mL、10.00mL分别放入100mL容量瓶中,加水稀释至约40mL,依次加入5mL盐酸(1+10)、 8mL乙醇(6.1.12)、6mL钼酸铵溶液(6.1.34),摇匀。放置30 min 后,加入20mL盐酸(1+1)、5mL抗坏血酸溶液(6.1.35),用水稀释至刻度,摇匀。常温下放置1h后,用分光光度计(6.2.14),10 mm比色皿,以水作参比,于波长660nm处测定溶液的吸光度。用测得的吸光度作为相对应的二氧化硅含量的函数,绘制工作曲线。
6.1.73 三氧化二铁(Fe2O3)标准溶液
6.1.73.1 三氧化二铁标准溶液的配制(0.1mg/mL)
称取0.1000g已于(950±25)℃灼烧过1h的三氧化二铁(Fe2O3,基准试剂),精确至0.0001g,置于300mL烧杯中,依次加入50mL水、30mL盐酸(1+1)、2mL硝酸,低温加热微沸,待溶解完全,冷却至室温后,移入1000mL容量瓶中,用水稀释至刻度,摇匀。
提示:如果三氧化二铁不能全部溶解,可采用无水碳酸钠(6.1.27)作熔剂在铂坩埚中于 950℃~1000℃下熔融,酸化后移入1000mL容量瓶中。
6.1.73.2 工作曲线的绘制
6.1.73.2.1 用于分光光度法的工作曲线的绘制
吸取每毫升含0.1 mg三氧化二铁的标准溶液0mL;1.00mL;2.00mL;3.00mL;4.00mL; 5.00mL;6.00mL分别放入100mL容量瓶中,加水稀释至约50mL,加入5mL抗坏血酸溶液(6.1.35),放置5min后,加入5mL邻菲罗啉溶液(6.1.36)、10mL乙酸铵溶液(6.1.37),用水稀释至刻度,摇匀。常温下放置30 min后,用分光光度计(6.2.14),10 mm比色皿,以水作参比,于波长510nm处测定溶液的吸光度。用测得的吸光度作为相对应的三氧化二铁含量的函数,绘制工作曲线。
6.1.73.2.2 用于原子吸收分光光度法的工作曲线的绘制
吸取每毫升含 0.1 mg三氧化二铁的标准溶液0mL;10.00mL;20.00mL;30.00mL;40.00mL; 50.00mL分别放入 500mL容量瓶中,加入30mL盐酸及10mL氯化锶溶液(6.1.40),用水稀释至刻度,摇匀。将原子吸收分光光度计(6.2.15)调节至最佳工作状态,在空气-乙炔火焰中,用铁元素空心阴极灯,于波长248.3nm处,以水校零测定溶液的吸光度。用测得的吸光度作为相对应的三氧化二铁含量的函数,绘制工作曲线。
6.1.74 氧化镁(MgO)标准溶液
6.1.74.1 氧化镁标准溶液的配制
称取1.0000g已于(950±25)℃灼烧过1h的氧化镁(MgO,基准试剂或光谱纯),精确至0.0001g,置于300mL烧杯中,加入50mL水,再缓缓加入20mL盐酸(1+1),低温加热至全部溶解,冷却至室温后,移入1000mL容量瓶中,用水稀释至刻度,摇匀。此标准溶液每毫升含1mg氧化镁。
吸取25.00mL上述标准溶液放入500mL.容量瓶中,用水稀释至刻度,摇匀。此标准溶液每毫升含0.05mg 氧化镁。
6.1.74.2 工作曲线的绘制
吸取每毫升含0.05mg 氧化镁的标准溶液0mL;2.00mL;4.00mL;6.00mL;8.00mL;10.00mL; 12.00mL分别放入 500mL容量瓶中,加入30mL盐酸及10mL氯化锶溶液(6.1.40),用水稀释至刻度,摇匀。将原子吸收分光光度计(6.2.15)调节至最佳工作状态,在空气-乙炔火焰中,用镁元素空心阴极灯,于波长285.2nm处,以水校零测定溶液的吸光度。用测得的吸光度作为相对应的氧化镁含量的函数,绘制工作曲线。
6.1.75 二氧化钛(TiO2)标准溶液
6.1.75.1 二氧化钛标准溶液的配制
称取0.1000 g已于(950±25)℃灼烧过1h的二氧化钛(TiO2,光谱纯),精确至0.0001g.置于铂坩埚中,加入4g~6 g焦硫酸钾(6.1.29),在700℃~750℃喷灯或高温炉中熔融至透明。冷却后,熔块用硫酸(1+9)浸出,加热至50℃~60℃使熔块全部溶解,冷却至室温后,移入1000mL容量瓶中,用硫酸(1+9)稀释至刻度,摇匀。此标准溶液每毫升含0.1mg二氧化钛。
吸取100.00mL上述标准溶液放入500mL容量瓶中,用硫酸(1+9)稀释至刻度,摇匀。此标准溶液每毫升含0.02mg二氧化钛。
6.1.75.2 工作曲线的绘制
吸取每毫升含0.02 mg 二氧化钛的标准溶液0mL;2.00mL;4.00mL;6.00mL;8.00mL;10.00mL;12.00mL;15.00mL分别放入100mL容量瓶中,依次加入10mL盐酸(1+2)、10mL抗坏血酸溶液(6.1.35)、5mL乙醇(6.1.12)、20mL二安替比林甲烷溶液(6.1.41),用水稀释至刻度,摇匀。常温下放置40 min 后,使用分光光度计(6.2.14),10 mm 比色皿,以水作参比,于波长 420nm处测定溶液的吸光度。用测得的吸光度作为相对应的二氧化钛含量的函数,绘制工作曲线。
6.1.76 氧化钾(K2O)、氧化钠(Na2O)标准溶液
6.1.76.1 氧化钾、氧化钠标准溶液的配制
称取1.5829g已于105℃~110℃烘过2h的氯化钾((KCl,基准试剂或光谱纯)及1.8859g已于105℃~110℃烘过2h的氯化钠(NaC1,基准试剂或光谱纯),精确至0.0001g.置于烧杯中,加水溶解后,移入1000mL容量瓶中,用水稀释至刻度,摇匀。贮存于塑料瓶中。此标准溶液每毫升含1 mg氧化钾及1 mg氧化钠。
吸取50.00mL上述标准溶液放入1000mL容量瓶中,用水稀释至刻度,摇匀。贮存于塑料瓶中。此标准溶液每毫升含0.05mg 氧化钾和0.05 mg氧化钠。
6.1.76.2 工作曲线的绘制
6.1.76.2.1 用于火焰光度法的工作曲线的绘制
吸取每毫升含1mg氧化钾及1mg氧化钠的标准溶液0mL;2.50mL;5.00mL;10.00mL; 15.00mL;20.00mL分别放入500mL容量瓶中,用水稀释至刻度,摇匀。贮存于塑料瓶中。将火焰光度计(6.2.16)调节至最佳工作状态,按仪器使用规程进行测定。用测得的检流计读数作为相对应的氧化钾和氧化钠含量的函数.绘制工作曲线。
6.1.76.2.2 用于原子吸收分光光度法的工作曲线的绘制
吸取每毫升含0.05mg氧化钾及0.05mg氧化钠的标准溶液0mL;2.50mL;5.00mL;10.00mL;15.00mL;20.00 mL;25.00 mL分别放入 500mL容量瓶中,加入 30mL盐酸及10mL.氯化锶溶液(6.1.40),用水稀释至刻度,摇匀,贮存于塑料瓶中。将原子吸收分光光度计(6.2.15)调节至最佳工作状态,在空气-乙炔火焰中,分别用钾元素空心阴极灯于波长 766.5nm 处和钠元素空心阴极灯于波长589.0nm处,以水校零测定溶液的吸光度。用测得的吸光度作为相对应的氧化钾和氧化钠含量的函数,绘制工作曲线。
6.1.77 一氧化锰(MnO)标准溶液
6.1.77.1 无水硫酸锰(MnSO4)
取一定量硫酸锰(MnSO4,基准试剂或光谱纯)或含水硫酸锰(MnSO4·xH2O,基准试剂或光谱纯)置于称量瓶中,在(250±10)℃温度下烘干至恒量,所获得的产物为无水硫酸锰(MnSO4)。
6.1.77.2 一氧化锰标准溶液的配制((0.05 mg/mL)
称取0.1064 g无水硫酸锰(6.1.77.1),精确至0.0001g,置于烧杯中,加水溶解后,加入约1mL硫酸(1+1),移入1000mL容量瓶中,用水稀释至刻度,摇匀。
6.1.77.3 工作曲线的绘制
6.1.77.3.1 用于分光光度法的工作曲线的绘制
吸取每毫升含 0.05 mg一氧化锰的标准溶液0mL;2.00mL;6.00mL;10.00mL;14.00mL;20.00mL分别放入200mL烧杯中,加入5mL磷酸(1+1)、10mL硫酸(1+1),加水稀释至约50mL,加入1 g高碘酸钾(6.1.47),加热微沸 30 min左右至溶液达到最大颜色深度,冷却至室温后,移入100mL 容量瓶中,用水稀释至刻度,摇匀。使用分光光度计(6.2.14),10mm 比色皿,以水作参比,于波长530nm处测定溶液的吸光度。用测得的吸光度作为相对应的一氧化锰含量的函数,绘制工作曲线。
6.1.77.3.2 用于原子吸收分光光度法的工作曲线的绘制
吸取每毫升含0.05mg一氧化锰的标准溶液0mL;5.00mL;10.00mL;15.00mL;20.00mL;25.00mL;30.00mL分别放入500mL容量瓶中,加入30mL盐酸及10mL氯化锶溶液(6.1.40),用水稀释至刻度,摇匀。将原子吸收分光光度计(6.2.15)调节至最佳工作状态,在空气-乙炔火焰中,用锰元素空心阴极灯,于波长279.5nm处,以水校零测定溶液的吸光度。用测得的吸光度作为相对应的一氧化锰含量的函数,绘制工作曲线。
6.1.78 五氧化二磷(P205)标准溶液
6.1.78.1 五氧化二磷标准溶液的配制
称取0.1917g已于105℃~110℃烘过2h的磷酸二氢钾(KH2PO4,基准试剂),精确至 0.0001g,置于烧杯中,加水溶解后,移入1000mL容量瓶中,用水稀释至刻度,摇匀。此标准溶液每毫升含0.1mg 五氧化二磷。
吸取50.00mL上述标准溶液放入500mL容量瓶中,用水稀释至刻度,摇匀。此标准溶液每毫升含0.01mg五氧化二磷。
6.1.78.2 工作曲线的绘制
吸取每毫升含0.01mg五氧化二磷的标准溶液0mL;2.00mL;4.00mL;6.00mL;8.00mL;10.00mL;15.00mL;20.00mL;25.00mL分别放入200mL烧杯中,加水稀释至50mL,加入10mL钼酸铵溶液(6.1.49)和2mL抗坏血酸溶液(6.1.50),加热微沸(1.5±0.5)min冷却至室温后,移入100mL容量瓶中,用盐酸(1+10)洗涤烧杯并用盐酸(1+10)稀释至刻度,摇匀。用分光光度计(6.2.14),10 mm比色皿,以水作参比,于波长730nm处测定溶液的吸光度。用测得的吸光度作为相对应的五氧化二磷含量的函数,绘制工作曲线。
6.1.79 氧化锌(ZnO)标准溶液
6.1.79.1 氧化锌标准溶液的配制
称取1.0000g氧化锌(ZnO,纯度不小于99.99%,精确至0.0001g.置于300mL烧杯中,加入50mL水,再加入20mL盐酸(1+1),加热溶解,冷却至室温,移入1000mL容量瓶中,用水稀释至刻度,摇匀。此标准溶液每毫升含1mg氧化锌。
吸取25.00mL上述标准溶液放入500mL容量瓶中,用水稀释至刻度,摇匀。此标准溶液每毫升含0.05mg 氧化锌。
6.1.79.2 工作曲线的绘制
吸取每毫升含0.05mg氧化锌的标准溶液0mL;1.00mL;2.00mL;3.00mL;4.00mL;5.00mL;6.00mL分别放入500mL容量瓶中,加入30mL盐酸及10mL氯化锶溶液(6.1.40),用水稀释至刻度,摇匀。将原子吸收分光光度计(6.2.15)调节至最佳工作状态,在空气-乙炔火焰中,用锌元素空心阴极灯,于波长213.8nm处,以水校零测定溶液的吸光度。用测得的吸光度作为相对应的氧化锌含量的函数,绘制工作曲线。
6.1.80 碳酸钙标准溶液[c(CaCO3)=0.024 mol/L]
称取0.6(m1)已于105℃~110℃烘过2h的碳酸钙(CaCO3,基准试剂),精确至0.0001g,置于300mL烧杯中,加入约100mL水,盖上表面皿,沿杯口慢慢加入6mL盐酸(1+1),搅拌至碳酸钙全部溶解,加热煮沸并微沸1min~2min。冷却至室温后,移入 250mL容量瓶中,用水稀释至刻度,摇匀。
6.1.81 EDTA 标准滴定溶液[c(EDTA)=0.015mol/L]
6.1.81.1 EDTA 标准滴定溶液的配制
称取5.6 g EDTA(乙二胺四乙酸二钠,C10H14N2O8Na2·2H2O)置于烧杯中,加入约200mL水,加热溶解,加水稀释至1L,摇匀,必要时过滤后使用。
6.1.81.2 EDTA 标准滴定溶液浓度的标定
吸取25.00mL碳酸钙标准溶液(6.1.80)放入300mL烧杯中,加水稀释至约200mL水,加入适量的CMP混合指示剂(6.1.94),在搅拌下加入氢氧化钾溶液(6.1.39)至出现绿色荧光后再过量2mL~3mL,用EDTA标准滴定溶液滴定至绿色荧光消失并呈现红色(V1)。
EDTA标准滴定溶液的浓度按式(1)计算:
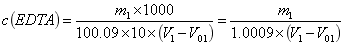 ............................(1)
............................(1)式中:
c(EDTA)——EDTA标准滴定溶液的浓度,单位为摩尔每升(mol/L);
m1 ——按6.180配制碳酸钙标准溶液的碳酸钙的质量,单位为克(g);
V1 ——滴定时消耗 EDTA标准滴定溶液的体积,单位为毫升(mL);
V01 ——空白试验滴定时消耗EDTA标准滴定溶液的体积,单位为毫升(mL);
100.09 ——CaCO3的摩尔质量,单位为克每摩尔(g/mol);
10 ——全部碳酸钙标准溶液与所分取溶液的体积比。
6.1.81.3 EDTA 标准滴定溶液对各氧化物的滴定度的计算
EDTA标准滴定溶液对三氧化二铁、三氧化二铝、氧化钙、氧化镁的滴定度分别按式(2)、式(3)、式(4)、式(5)计算:
TFe2O3=c(EDTA)×79.84 ……………..............(2)
TA12O3=c(EDTA)×50.98 ……………………(3)
TCaO=c(EDTA)× 56.08 ……………………(4)
TMgO=c(EDTA)×40.31 ……………………(5)
TFe2O3 ——EDTA标准滴定溶液对三氧化二铁的滴定度,单位为毫克每毫升(mg/mL);
TA12O3 ——EDTA标准滴定溶液对三氧化二铝的滴定度,单位为毫克每毫升(mg/mL);
TCaO ——EDTA标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);
TMgO ——EDTA标准滴定溶液对氧化镁的滴定度,单位为毫克每毫升(mg/mL);
c(EDTA)——EDTA标准滴定溶液的浓度,单位为摩尔每升(mol/L);
79.84 ——(1/2Fe2O3)的摩尔质量,单位为克每摩尔(g/mol);
50.98 ——(1/2A12O3)的摩尔质量,单位为克每摩尔(g/mol);
56.08 ——CaO的摩尔质量,单位为克每摩尔(g/mol);
40.31 ——MgO的摩尔质量,单位为克每摩尔(g/mol)。
6.1.82 硫酸铜标准滴定溶液[c(CuSO4)=0.015 mol/L]
6.1.82.1 硫酸铜标准滴定溶液的配制
称取3.7g硫酸铜(CuSO4· 5H2O)溶于水中,加入4滴~5滴硫酸(1+1),加水稀释至1L摇匀。
6.1.82.2 EDTA 标准滴定溶液与硫酸铜标准滴定溶液体积比的标定
从滴定管中缓慢放出10.00mL~15.00mL EDTA标准滴定溶液(V2,6.1.81)于300mL烧杯中,加水稀释至约150 mL,加入15mL pH4.3的缓冲溶液(6.1.55),加热至沸,取下稍冷,加入4滴~5滴PAN 指示剂溶液(6.1.99),用硫酸铜标准滴定溶液滴定至亮紫色(V3)。
EDTA标准滴定溶液与硫酸铜标准滴定溶液的体积比按式(6)计算
 …………(6)
…………(6)K1——EDTA标准滴定溶液与硫酸铜标准滴定溶液的体积比;
V2——加入EDTA标准滴定溶液的体积,单位为毫升(mL);
V3——滴定时消耗硫酸铜标准滴定溶液的体积,单位为毫升(mL)。
6.1.83 氢氧化钠标准滴定溶液[c(NaOH)=0.15mol/L]
6.1.83.1 氢氧化钠标准滴定溶液的配制
称取30 g氢氧化钠(NaOH)溶于水后,加水稀释至5L,充分摇匀,贮存于塑料瓶或带胶塞(装有钠石灰干燥管)的硬质玻璃瓶内。
6.1.83.2 氢氧化钠标准滴定溶液浓度的标定
称取0.8 g(m2)苯二甲酸氢钾(C8H5KO4,基准试剂),精确至0.0001g,置于300mL烧杯中,加入约200mL预先新煮沸过并冷却后用氢氧化钠溶液中和至酚酞呈微红色的冷水,搅拌使其溶解,加入6~7滴酚酞指示剂溶液(6.1.97),用氢氧化钠标准滴定溶液滴定至微红色(V4)。
氢氧化钠标准滴定溶液的浓度按式(7)计算:
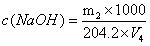 ……..........(7)
……..........(7)式中:
c(NaOH)——氢氧化钠标准滴定溶液的浓度,单位为摩尔每升(mol/L);
m2 ——苯二甲酸氢钾的质量,单位为克(g);
V4 ——滴定时消耗氢氧化钠标准滴定溶液的体积,单位为毫升(mL);
204.2 ——苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)。
6.1.83.3 氢氧化钠标准滴定溶液对二氧化硅的滴定度的计算
氢氧化钠标准滴定溶液对二氧化硅的滴定度按式(8)计算:
TSiO2=c(NaOH)×15.02
式中:
TSiO2 ——氢氧化钠标准滴定溶液对二氧化硅的滴定度,单位为毫克每毫升(mg/mL);
c(NaOH)——氢氧化钠标准滴定溶液的浓度,单位为摩尔每升(mol/L);
15.02 ——(1/4 SiO2)的摩尔质量,单位为克每摩尔(g/mol)。
6.1.84 碘酸钾标准滴定溶液[(1/6KIO3)=0.03mo/L]
称取1.0701g已于180℃烘过2h的碘酸钾(KIO3,基准试剂),精确至0.001g,溶于约200mL新煮沸过的冷水中,加入0.2g~0.5g氢氧化钠(NaOH)及25g碘化钾(KI),溶解后移入1000 mL容量瓶中,再用新煮沸过的冷水稀释至刻度,摇匀。
6.1.85 硫代硫酸钠标准滴定溶液[c(Na2S203)=0.03mol/L]
6.1.85.1 硫代硫酸钠标准滴定溶液的配制
将 7.5g硫代硫酸钠(Na2S203·5H2O)溶于200mL新煮沸过的冷水中,加入0.05 g无水碳酸钠(6.1.27),溶解后再用新煮沸过的冷水稀释至1L,摇匀,贮存于棕色瓶中。
提示:由于硫代硫酸钠标准溶液不稳定,建议在每批试验之前,要重新标定碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比
6.1.85.2 碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液体积比的标定
从滴定管中缓慢放出15.00mL碘酸钾标准滴定溶液(6.1.84)于250mL锥形瓶中加入50mL水及20mL盐酸(1+1),在摇动下用硫代硫酸钠标准滴定溶液滴定至淡黄色后,加入约2mL淀粉溶液(6.1.103),再继续滴定至蓝色消失(V5).
碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比按式(9)计算:
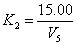 ………………………(9)
………………………(9)式中:
K2——碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比;
15.00——加入碘酸钾标准滴定溶液的体积,单位为毫升(mL);
V5——滴定时消耗硫代硫酸钠标准滴定溶液的体积,单位为毫升(mL)。
6.1.86 高锰酸钾标准滴定溶液[c(1/5KMnO4)=0.18moL/L]
6.1.86.1 高锰酸钾标准滴定溶液的配制
称取5.7g高锰酸钾(KMnO4)置于2000mL烧杯中,溶于1050mL水中,加热微沸15min左右,于暗处放置一周后,用玻璃砂芯漏斗(6.2.28)或垫有一层玻璃棉的漏斗过滤上面的清液,不扰动底部的沉淀物。然后将滤液贮存于棕色瓶中,摇匀。不要用含有机质的材料进行过滤。
提示:由于高锰酸钾标准滴定溶液不稳定,建议每次使用前重新标定。
6.1.86.2 高锰酸钾标准滴定溶液浓度的标定
称取 0.5g(m3)已于105℃~110℃烘过2h的草酸钠(Na2C2O4,基准试剂),精确至0.000lg,置于400mL烧杯中,加入约150mL水、20mL硫酸(1+1),加热至70℃~80℃,用高锰酸钾标准滴定溶液滴定至微红色出现,并保持30s不消失(V6).
高锰酸钾标准滴定溶液的浓度按式(10)计算:
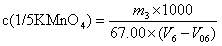 ………(10)
………(10)式中:
c(1/5KMnO4)-—高锰酸钾标准滴定溶液的浓度,单位为摩尔每升(mol/L);
m3——草酸钠的质量,单位为克(g);
V6——滴定时消耗高锰酸钾标准滴定溶液的体积,单位为毫升(mL);
V06——空白试验滴定时滴定时消耗高锰酸钾标准滴定溶液的体积,单位为毫升(mL);
67.00——(1/2Na2C2O4,)的摩尔质量,单位为克每摩尔(g/mol)。
6.1.86.3 高锰酸钾标准滴定溶液对氧化钙的滴定度的计算
高锰酸钾标准滴定溶液对氧化钙的滴定度按式(11)计算:
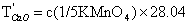 ………(11)
………(11)式中:
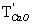 ——高锰酸钾标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);
——高锰酸钾标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);c(1/5KMnO4)——高锰酸钾标准滴定溶液的浓度,单位为摩尔每升(mol/L);
28.04——(1/2CaO)的摩尔质量,单位为克每摩尔(g/mol)
6.1.87 氢氧化钠标准滴定溶液[c′(NaOH)=0.06 mol/L]
6.1.87.1 氢氧化钠标准滴定溶液的配制
称取12 g氢氧化钠(NaOH)溶于水后,加水稀释至5L,充分摇匀,贮存于塑料瓶或带胶塞(装有钠石灰干燥管)的硬质玻璃瓶内。
6.1.87.2 氢氧化钠标准滴定溶液浓度的标定
|称取0.3g(m4)苯二甲酸氢钾(C8H5KO4,基准试剂),精确至0.0001g,置于300mL烧杯中,加入约200mL预先新煮沸过并冷却后用氢氧化钠溶液中和至酚酞呈微红色的冷水,搅拌使其溶解,加入6滴~7滴酚酞指示剂溶液(6.1.97),用氢氧化钠标准滴定溶液滴定至微红色(V7)。
氢氧化钠标准滴定溶液的浓度按式(12)计算:
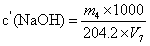 …………(12)
…………(12)式中:
c′(NaOH)——氢氧化钠标准滴定溶液的浓度,单位为摩尔每升(mol/L);
m4——苯二甲酸氢钾的质量,单位为克(g)
V7——滴定时消耗氢氧化钠标准滴定溶液的体积,单位为毫升(mL);
204.2——苯二甲酸氢钾的摩尔质量,单位为克每摩(g/mol)。
6.1.87.3 氢氧化钠标准滴定溶液对三氧化硫的滴定度的计算
氢氧化钠标准滴定溶液对三氧化硫滴定度按式(13)计算:
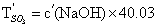 …………………(13)
…………………(13)式中:
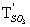 ——氢氧化钠标准滴定溶液对三氧化硫的滴定度,单位为毫克每毫升(mg/mL);
——氢氧化钠标准滴定溶液对三氧化硫的滴定度,单位为毫克每毫升(mg/mL);c′(NaOH)——氢氧化钠标准滴定溶液的浓度,单位为摩尔每升(mol/L);
40.03 ——(1/2SO3)的摩尔质量,单位为克每摩尔(g/mol)。
6.1.1.88 氯离子标准溶液[c(NaCl)=0.02 mol/]
称取 0.5844 g 已于105℃~110℃烘过2h的氯化钠(NaCl,基准试剂或光谱纯),精确至0.0001 g,置于烧杯中,加水溶解后,移入500mL容量瓶中,用水稀释至刻度,摇匀。
6.1.89 硝酸银标准滴定溶液[c(AgNO3)=0.02mol/L]
6.1.89.1 硝酸银标准滴定溶液的配制
称取1.70 g硝酸银(AgNO3),精确至0.0001g,置于烧杯中,加水溶解后,移入 500mL容量瓶中,用水稀释至刻度,摇匀,贮存于棕色瓶中,避光保存。
6.1.89.2 硝酸银标准滴定溶液浓度的标定
吸取10.00mL氯离子标准溶液(6.1.88)放入250mL烧杯中,加入2mL硝酸(1+1),用水稀释至约150mL,放入一根磁力搅拌棒。把烧杯放在磁力搅拌器(6.2.13)上,用氯离子电位滴定装置(6.2.22)测量溶液的电位,在溶液中插入氯离子电极(6.2.23)和甘汞电极(6.2.24),开始搅拌。用硝酸银标准滴定溶液逐渐滴定,化学计量点前后,每次滴加0.10mL硝酸银标准滴定溶液,记录滴定管读数和对应的毫伏计读数。计量点前,毫伏计读数变化越来越大;过计量点后,每滴加一次溶液,变化又将减小。继续滴定至毫伏计读数变化不大时为止。用二次微商法计算或氯离子电位滴定装置(6.2.22)计算出消耗的硝酸银标准滴定溶液的体积(V8)。二次微商法的计算参见附录 A。
硝酸银标准滴定溶液的浓度按式(14)计算:
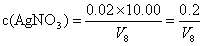 …………(14)
…………(14)式中:
c(AgNO3)——硝酸银标准滴定溶液的浓度,单位为摩尔每升(mol/L);
V8——滴定时消耗硝酸银标准滴定溶液的体积,单位为毫升(mL);
0.02——氯离子标准溶液的浓度,单位为摩尔每升(mol/L);
10.00 ——加入氯离子标准溶液的体积,单位为毫升(mL)。
6.1.89.3 硝酸银标准滴定溶液对氯离子的滴定度的计算
硝酸银标准滴定溶液对氯离子的滴定度按式(15)计算:
TCl- =c(AgNO3)×35.45 ……………………(15)
式中:
TCl- ——硝酸银标准滴定溶液对氯离子的滴定度,单位为毫克每毫升(mg/mL);
c(AgNO3)——硝酸银标准滴定溶液的浓度,单位为摩尔每升(mol/L;
35.45——Cl- 的摩尔质量,单位为克每摩尔(g/mol)。
6.1.90 氯离子标准溶液
6.1.90.1 氯离子标准溶液的配制(1mg/mL)
称取1.6485g已于105℃~110℃烘过2h的氯化钠(NaCl,基准试剂或光谱纯),精确至0.0001 g,置于200mL烧杯中,加水溶解后,移入1000mL容量瓶中,用水稀释至刻度,摇匀。
6.1.90.2 氯离子标准溶液的配制(0.1mg/ml )
吸取100.00mL氯离子标准溶液(6.1.90.1)放入1000mL.容量瓶中,用水稀释至刻度,摇匀。
6.1.90.3 工作曲线的绘制
吸取每毫升含0.1 mg氯离子的标准溶液0mL;0.50mL;1.00mL;5.00mL;10.00mL;25.00mL分别放入100mL容量瓶中,用水稀释至刻度,摇匀。此系列标准溶液分别每毫升含0mg;0.0005mg;0.001 mg;0.05 mg;0.010 mg;0.025mg氯离子。将系列标准溶液注入离子色谱中分离,得到色谱图,
测定所得色谱峰的峰面积或峰高。用测得的峰面积或峰高作为相对应的氯离子浓度的函数,绘制工作曲线。
6.1.91 氟离子(F-)标准溶液
6.1.91.1 氟离子标准溶液的配制
称取0.2763g 已于105℃~110℃烘过2h的氟化钠(NaF,优级纯),精确至0.0001g,置于塑料烧杯中,加水溶解后,移入500mL容量瓶中,用水稀释至刻度,摇匀。贮存于塑料瓶中。此标准溶液每毫升含0.25mg氟离子。
吸取每毫升含0.25mg氟离子的标准溶液2.00mL;10.00mL;20.00mL;40.00mL;60.00mL分别放入500mL容量瓶中,用水稀释至刻度,摇匀,贮存于塑料瓶中。此系列标准溶液分别每毫升含0.001 mg;0.005mg;0.010mg;0.020mg;0.030 mg氟离子。
6.1.91.2 工作曲线的绘制
移取6.1.91.1中系列标准溶液各10.00mL,放入置有一磁力搅拌子的50mL干烧杯中。加入10.00 mL pH6的总离子强度配位缓冲液(6.1.65),将烧杯置于磁力搅拌器(6.2.13)上,在溶液中插入氟离子电极(6.2.26)和饱和氯化钾甘汞电极(6.2.24),开动磁力搅拌器(6.2.13)搅拌2 min,停搅30s。用离子计或酸度计(6.2.25)测量溶液的平衡电位。以对数坐标为氟离子的浓度,常数坐标为电位值,用回归方程计算或在半单对数坐标纸上绘制工作曲线。
6.1.92 苯甲酸-无水乙醇标准滴定溶液[c(C6H5COOH)=0.1 mol/L]
6.192.1 苯甲酸-无水乙醇标准滴定溶液的配制
称取12.2g已在干燥器(6.2.6)中干燥 24h后的苯甲酸(C6H5COOH)溶于1000mL无水乙醇(6.1.13)中,贮存于带胶塞(装有硅胶干燥管)的玻璃瓶内。
6.1.92.2 苯甲酸-无水乙醇标准滴定溶液对氧化钙滴定度的标定
6.1.92.2.1 用于甘油酒精法的滴定度的标定
取一定量碳酸钙(CaCO3),基准试剂)置于铂(或瓷)坩埚中,在(950±25)℃下灼烧至恒量,从中称取0.04 g氧化钙(m5),精确至0.0001g,置于250mL干燥的锥形瓶中,加入30mL甘油-无水乙醇溶液(6.1.67),加入1g硝酸锶(6.1.68),放入一根干燥的搅拌子,装上冷凝管,置于游离氧化钙测定仪(6.2.27)
上,以适当的速度搅拌溶液,同时升温并加热煮沸,在搅拌下微沸10 min后,取下锥形瓶,立即用苯甲酸-无水乙醇标准滴定溶液滴定至微红色消失。再装上冷凝管,继续在搅拌下煮沸至红色出现,再取下滴定。如此反复操作,直至在加热10 min后不出现红色为止(V9)。
苯甲酸-无水乙醇标准滴定溶液对氧化钙的滴定度按式(16)计算:
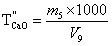 ………………(16)
………………(16)式中:
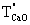 ——苯甲酸-无水乙醇标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);
——苯甲酸-无水乙醇标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);m5——氧化钙的质量,单位为克(g);
V9——滴定时消耗苯甲酸-无水乙醇标准滴定溶液的总体积,单位为毫升(mL)。
6.1.92.2.2 用于乙二醇法的滴定度的标定
取一定量碳酸钙(CaCO3,基准试剂)置于铂(或瓷)坩埚中,在(950±25)℃下灼烧至恒量,从中称取0.04g氧化钙(m6),精确至 0.0001g,置于250 mL干燥的锥形瓶中,加入30mL乙二醇-乙醇溶液(6.1.69),放入一根干燥的搅拌子,装上冷凝管,置于游离氧化钙测定仪(6.2.27)上,以适当的速度搅拌溶液,同时升温并加热煮沸,当冷凝下的乙醇开始连续滴下时,继续在搅拌下加热微沸5min,取下锥形瓶,立即用苯甲酸-无水乙醇标准滴定溶液滴定至微红色消失(V10)。
苯甲酸-无水乙醇标准滴定溶液对氧化钙的滴定度按式(17))计算:
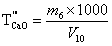 …………………………(17)
…………………………(17)式中:
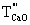 ——苯甲酸-无水乙醇标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);
——苯甲酸-无水乙醇标准滴定溶液对氧化钙的滴定度,单位为毫克每毫升(mg/mL);m6——氧化钙的质量,单位为克(g);
V10——滴定时消耗苯甲酸无水乙醇标准滴定溶液的体积,单位为毫升(mL).
6.1.93 EDTA-铜溶液
按 EDTA标准滴定溶液(6.1.81)与硫酸铜标准滴定溶液的体积比(6.1.82.2),准确配制成等物质的量浓度的混合溶液。
6.1.94 钙黄绿素-甲基百里香酚蓝-酚酞混合指示剂(简称CMP混合指示剂)
称取1.00g钙黄绿素、1.00g甲基百里香酚蓝、0.20g酚酞与50g已在105℃~110℃烘干过的硝酸钾(KNO3),混合研细,保存在磨口瓶中。
6.1.95 酸性铬蓝K-萘酚绿B混合指示剂(简称KB混合指示剂)
称取1.00g酸性铬蓝K、2.50 g萘酚绿B与50 g 已在105℃~110℃烘干过的硝酸钾(KNO3),混合研细,保存在磨口瓶中。
滴定终点颜色不正确时,可调节酸性铬蓝 K与萘酚绿B的配制比例,并通过有证标准样品/标准物质进行对比确认。
6.1.96 甲基红指示剂溶液(2g/L)
将0.2g甲基红溶于100 mL乙醇(6.1.12)中。
6.1.97 酚酞指示剂溶液(10 g/L)
将1g 酚酞溶于100mL乙醇(6.1.12)中。
6.1.98 磺基水杨酸钠指示剂溶液(100g/L)
将10 g磺基水杨酸钠(C7H5O6SNa·2H2O)溶于水中,加水稀释至100mL。
6.1.99 1-(2-吡啶偶氮)-2萘酚指示剂溶液(简称 PAN指示剂溶液)(2g/L)
将 0.2 g1-(2-吡啶偶氮)-2萘酚溶于100mL乙醇(6.1.12)中。
6.1.100 溴酚蓝指示剂溶液(2g/L)
将0.2g溴酚蓝溶于100mL乙醇(1+4)中。
6.1.101 硫酸铁铵指示剂溶液
将10mL硝酸(1+2)加入到100mL冷的硫酸铁(Ⅲ)铵[NH4Fe(SO4)2·12H2O]饱和水溶液中。
6.1.102 对硝基酚指示剂溶液(2g/L)
将0.2g对硝基酚溶于100mL水中。
6.1.103 淀粉溶液(10g/L)
将1g 淀粉(水溶性)置于烧杯中,加水调成糊状后,加入100 mL沸水,煮沸约1 min.冷却后使用。
6.1.104 硫酸铜溶液(50 g/L)
将5 g硫酸铜(CuSO4·5H2O)溶于100mlL水中。
6.1.105 硫酸铜(CuSO4·5H2O)饱和溶液。
6.1.106 硫化氢吸收剂
将一定量的粒度在1 mm~2.5mm 的干燥浮石放在一个平盘内,然后用一定体积的硫酸铜饱和溶液(6.1.105)浸泡,硫酸铜溶液的质量约为浮石质量的一半。把混合物放在(150±5)℃的干燥箱(6.2.6)内,在玻璃棒经常搅拌下,蒸发混合物至干,烘干5h以上,将固体混合物冷却后,密封保存。
6.1.107 碱石棉(二氧化碳吸收剂)
碱石棉,粒度1 mm~2 mm(10目~20目),化学纯,密封保存。
6.1.108 无水高氯酸镁[Mg(ClO4)2]制成粒度0.6 mm~2mm,贮存于密封瓶内。
6.1.109 钠石灰
粒度2mm~5mm,医药用或化学纯,密封保存。
6.1.110 硝酸银溶液(5g/L)
将5g硝酸银(AgNO3)溶于水中,加水稀释至1L.
6.1.111 滤纸浆
将定量滤纸撕成小块,放入烧杯中,加水浸没,在搅拌下加热煮沸10 min 以上,冷却后放入广口瓶中备用。
上一篇:水泥化学分析方法-试样制备
下一篇:水泥化学分析方法—仪器与设备













